几何异构是有机化学中的一个知识点,有机化学向来是同学们学习的难点和重点,下面就一起来看看我们给大家准备了哪些IB化学立体异构知识点吧!
几何异构
产生的原因:双键或环使单键的自由旋转受到限制,而使分子具有不同的空间排布方式,即构型不同。含双键的化合物:只要有一个双键原子连有相同的原子或基团,就不存在顺反异构(N原子上的孤对电子可看成是一个基团)。
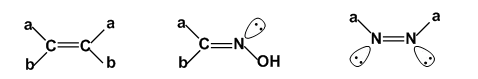
环烃化合物:必须两个或两个以上的环碳原子连有不同的原子或基团。
旋光异构
如果一个分子与其镜象不能重叠,它就是手性分子。手性分子又称为光学活性化合物。互为镜象的两个化合物称为对映异构体,简称对映体。互为对映体的两个化合物,除旋光方向相反外,一般的化学性质、物理性质相同。一个化合物有无手性,一般可根据分子是否存在对称面(或对称中心)来判断。如果一个分子没有对称面(或对称中心),则该分子即为手性分子。
(1)判断饱和化合物分子是否有手性:——通常看是否有手性碳原子。若分子中只含一个手性碳原子,它一定是手性分子,存在一对对映体。

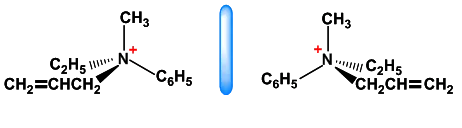
(2)杂原子的对映异构:
(3)环状化合物:顺反异构和旋光异构往往同时存在。顺式异构体、1,3 – 二取代环丁烷、1,4 – 二取代环己烷(无论两个取代基相同与否,是顺式还是反式)均因有对称面而无旋光性。

其他三元、四元、五元、六元环状化合物,只要是反式异构体,因分子中既无对称面,也无对称中心,因而均有旋光性(无论两个取代基相同与否)。
构象异构
一般是指同一构型分子中由于单键旋转而产生的原子或基团在空间的不同排列形式,这种异构称为构象异构。
在构型一定的分子的无数个构象中,其优势构象(即稳定构象)通常是能量最低的构象。判断分子构象的稳定性主要考虑:各种张力和偶极– 偶极相互作用,一般说来,稳定构象是各种张力最小,偶极– 偶极相互作用最大的那种排列。
(1)开链烃及其衍生物:从能量上看:大的原子或基团处于对位交叉式是最稳定的构象,因为这样排布原子或基团彼此间的距离最远,相互排斥力最小。
(2)环己烷及取代环己烷的优势构象:环己烷的优势构象:椅式
一取代环己烷的优势构象:取代基处于e键
二取代环己烷的优势构象:在满足两个取代基空间构型的前提下,处于e键的 取代基多者稳定;大的取代基处于e键稳定。
IBO已经官宣了2022年IB大考的新政策,这意味着新一年的学习应考已经到来,如果不知道怎么学好化学这样的核心选课,有需要的同学可以点击预约试听【IB同步培训班】——

点击
IB化学考试答题注意事项分享来了 快来拿满你的IB化学7分吧
查看。









































 沪公网安备 31010502004453号
沪公网安备 31010502004453号




 成功提交后我们将尽快与您联系,请注意来电哦!
成功提交后我们将尽快与您联系,请注意来电哦!











