在AP化学的大纲中,对于同学们的PH值计算有明确的要求,同学们对于这部分的知识点都掌握扎实了吗?下面来给大家分析一下AP化学PH值计算方法吧!

pH = - log (H+)
pH = - log [ H+]
强酸:c mol·L-1HnA强酸溶液,c(H+)=nc mol·L-1―→pH=-lg nc。
强酸与强酸混合后pH的计算方法
c(H+)混=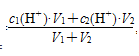 ,然后再求pH。
,然后再求pH。
强碱
c mol·L-1B(OH)n强碱溶液,c(OH-)=nc mol·L-1,
n(H+)= mol·L-1―→pH=14+lg_nc。
纯水(H2O), pH = 7, pOH = 7
强酸的溶液(HCl(aq)),直接计算H+的浓度,再使用pH = -log10[H+];同样的道理,如果是强碱的溶液(NaOH(aq)),直接计算OH-的浓度,再使用pOH = -log10[OH-], pH = 14- pOH
弱酸的溶液(CH3COOH (aq)),需要使用弱酸的平衡常数Ka,,计算H+的浓度,再使用pH = -log10[H+];同样的,若是弱碱溶液(NH3H2O (aq)),需要使用弱碱的平衡常数Kb,,计算OH-的浓度,再使用pOH = -log10[OH-]
强酸和弱酸的混合溶液(HCl(aq) & CH3COOH (aq)),或强碱和弱碱的混合溶液(NaOH(aq) & NH3H2O), 大胆忽略弱酸或弱碱对于pH的影响,采用②的计算方式。
强酸和强碱混合,发生酸碱中和,无论是酸过量还是碱过量,依然是采用②的方式计算;若二者刚好完全反应,pH = 7。
强酸和弱碱混合,发生酸碱中和(neutralization),如果强酸过量,情况类似于强酸溶液,使用方式计算;如果弱碱过量,此时的溶液是缓冲溶液,需要使用弱碱的平衡常数Kb,代入过量的弱碱的浓度和生成的共轭酸(conjugate acid)的浓度,先计算出pOH;(如果弱碱的浓度和生成的共轭酸浓度相等,pKb = pOH)。
弱酸和强碱混合,发生酸碱中和,如果强碱过量,情况类似于强碱溶液,使用强碱溶液的方式计算;如果弱酸过量,此时的溶液是缓冲溶液,需要使用弱酸的平衡常数Ka,代入过量的弱酸的浓度和生成的共轭碱(conjugate base),先计算出pH;(如果弱碱的浓度和生成的共轭酸浓度相等,pKb = pOH)。
希望以上内容可以帮大家更好地学习AP化学。每年都有很多基础很好的考生在AP考试中失败,也有很多基础一般但是勤奋学习的考生拿到理想分,由此可见比起基础,学习方法更关键。如果你还找更好的AP学习方法,希望一年复习多门也能门门拿理想分,可以点击预约试听【AP复习冲刺班】——

点击
查看。










































 沪公网安备 31010502004453号
沪公网安备 31010502004453号




 成功提交后我们将尽快与您联系,请注意来电哦!
成功提交后我们将尽快与您联系,请注意来电哦!











